H2CO là một hợp chất hữu cơ và được phân loại là một andehit. Andehyt là những hóa chất có nhóm chức -HCO- trong phân tử của chúng và formaldehyde là thành phần thấp nhất của nhóm này với một nguyên tử carbon.
Formaldehyde phân tử là một loại khí độc, không màu, có mùi khó chịu và hăng. Ở dạng rắn, nó có thể tồn tại dưới dạng trimer (1,3,5-trioxan) hoặc dạng polyme được gọi là Paraformaldehyde.
Formaldehyde thường được lưu trữ trong dung dịch nước được gọi là formalin. Hóa chất này, do khả năng phản ứng cao của nó, cũng là một trong những khối xây dựng quan trọng nhất của hóa học tổng hợp.
Thuộc tính của Formaldehyde
- Nó có khối lượng mol là 30,02 g·mol −1 .
- Nó là một loại khí độc có mùi khó chịu và hăng.
- Nó có nhiệt độ sôi -19 ° C và nhiệt độ nóng chảy -92 ° C.
- Nó hòa tan trong acetone cũng như trong dung dịch nước
| Tên phân tử | Formaldehyde |
| Công thức hóa học | H2CO |
| Dạng hình học phân tử của H2CO | Tam giác phẳng |
| Hình học electron của H2CO | Tam giác phẳng |
| lai tạo | sp2 |
| Thiên nhiên | Phân tử phân cực |
| Tổng số electron hóa trị cho H2CO | 12 |
Cách vẽ cấu trúc lewis cho H2CO
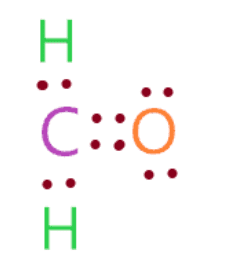
Cấu trúc của H2CO lewis được tạo thành từ một oxy, một carbon và hai hydro. Các nguyên tử này được cấu trúc theo cách mà nguyên tử carbon được giữ ở vị trí trung tâm và nó được liên kết với hai hydro bằng một liên kết đơn và liên kết đôi với một nguyên tử oxy.
Có tổng cộng 2 cặp đơn độc và 4 cặp liên kết (hai liên kết đơn + một liên kết đôi) có trong cấu trúc lewis của H2CO.
Chúng ta hãy xem làm thế nào để vẽ cấu trúc lewis dot của H2CO với một số bước đơn giản.
Thực hiện theo một số bước để vẽ cấu trúc chấm lewis của H2CO
Đếm tổng số electron hóa trị trong H2CO
Như chúng ta đã biết, sơ đồ lewis là biểu diễn electron hóa trị của các nguyên tử trong phân tử. Các electron hóa trị là electron ngoài cùng của một nguyên tử có thể tham gia vào sự hình thành liên kết bằng cách cho hoặc nhận.
Vì vậy, trong bước đầu tiên, chúng ta sẽ tìm electron hóa trị của H2CO. Để tính toán điều này, hãy nhìn vào nhóm carbon, hydro và oxy định kỳ.
Nguyên tử carbon thuộc nhóm 4A hoặc thứ 14 trong bảng tuần hoàn, do đó, nó có 4 electron hóa trị. Nguyên tử oxy thuộc Nhóm 6A hoặc 16, do đó, nó có 6 electron hóa trị trong khi nguyên tử hydro nằm ở Nhóm 1A, do đó số lượng electron hóa trị trong hydro là 1.
⇒ Tổng số electron hóa trị trong carbon = 4
⇒ Tổng số electron hóa trị trong oxi = 6
⇒ Tổng số electron hóa trị trong hiđro = 1
∴ Tổng số electron hóa trị có sẵn để vẽ cấu trúc Lewis của H2CO = 4 + 1(2) + 6 = 12 electron hóa trị [∴H2CO phân tử có một carbon, một oxy và hai hydro]
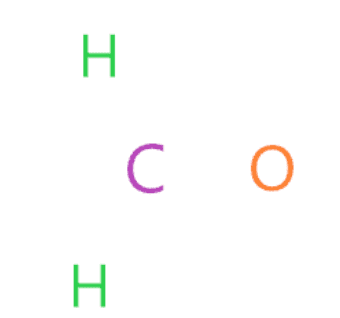
Tìm nguyên tử có độ âm điện nhỏ nhất và đặt nó ở tâm
Bước này đôi khi có thể phức tạp nhưng trong trường hợp của phân tử H2CO, rất dễ xác định các nguyên tử có độ âm điện nhỏ nhất để đặt ở vị trí trung tâm trong sơ đồ lewis.
Mọi người nên nhớ rằng nguyên tử hydro không bao giờ có thể chiếm vị trí trung tâm trong sơ đồ lewis vì nó chỉ có thể có tối đa hai electron hóa trị ở lớp vỏ ngoài, do đó, nó không bao giờ có thể chia sẻ nhiều hơn hai electron nếu cần.
Vì vị trí trung tâm đòi hỏi nguyên tử có xu hướng chia sẻ electron với các nguyên tử khác. Độ âm điện của nguyên tử oxi là 3,44 và của nguyên tử cacbon là 2,55.
Do đó, đặt carbon ở vị trí trung tâm trong khi trải đều các nguyên tử oxy và hydro xung quanh nó.
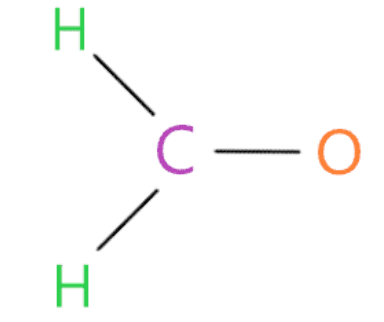
Nối nguyên tử ngoài cùng với nguyên tử trung tâm bằng liên kết đơn
Trong bước này, liên kết từng nguyên tử bên ngoài (oxy và hydro) với nguyên tử trung tâm (cacbon) với sự trợ giúp của một liên kết đơn.
Bây giờ chúng ta sẽ đếm xem chúng ta đã sử dụng bao nhiêu electron hóa trị trong cấu trúc trên. Trong cấu trúc trên, chúng tôi đã sử dụng ba liên kết đơn để kết nối hai nguyên tử hydro và một nguyên tử oxy với nguyên tử trung tâm (cacbon).
Một liên kết đơn có nghĩa là hai electron, do đó, (3 liên kết đơn × 2) = 6 electron hóa trị được sử dụng trong tổng số 12 electron hóa trị có sẵn để vẽ cấu trúc Lewis của H2CO.
∴ (12 – 6) = 6 electron hóa trị
Vì vậy, chúng ta còn lại 6 electron hóa trị nữa.
Đặt các electron hóa trị còn lại bắt đầu từ nguyên tử bên ngoài trước
Bây giờ chúng ta sẽ bắt đầu đưa các electron hóa trị còn lại vào các nguyên tử bên ngoài để hoàn thành bộ tám của chúng. Trong một phân tử H2CO, các nguyên tử oxy và hydro là những nguyên tử bên ngoài.
Nguyên tử hydro chỉ cần hai electron hóa trị để hoàn thành bộ tám của nó và đạt được sự ổn định, hơn nữa, nguyên tử oxy cần 8 electron để hoàn thành bộ tám và ở dạng ổn định.
Nếu bạn nhìn vào cấu trúc bước thứ 3 , cả hai nguyên tử hydro đều đã nhận được hai electron ở lớp vỏ ngoài của chúng dưới dạng một liên kết đơn, do đó, cả hai nguyên tử này đã hoàn thành bộ tám của chúng.
Vì vậy, chỉ cần đặt electron hóa trị còn lại trên nguyên tử oxy cho đến khi nó hoàn thành vỏ octet.
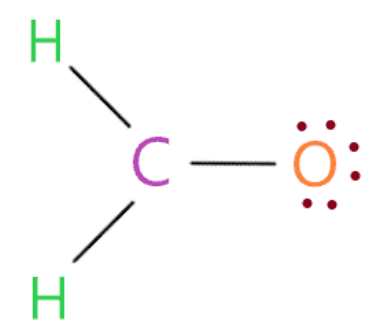
Vì vậy, bằng cách nhìn vào cấu trúc trên, chúng ta thấy nguyên tử oxy có 8 electron (6 electron được biểu thị bằng dấu chấm + 2 electron trong một liên kết đơn được kết nối với nó) trong vỏ octet của nó. Do đó, nó cũng hoàn thành octet của nó.
Trong cấu trúc trên, chúng ta đã sử dụng tổng cộng 12 electron hóa trị (ba liên kết đơn chứa 6 electron và 6 electron là dấu chấm).
Do đó, bây giờ chúng ta không còn electron hóa trị nào.
Hoàn thành octet nguyên tử trung tâm và tạo liên kết cộng hóa trị nếu cần
Nguyên tử trung tâm trong phân tử H2CO là carbon cũng cần 8 electron ở lớp vỏ ngoài để hoàn thành octet. Ở cấu trúc bậc 4 , chúng ta thấy nguyên tử carbon có 6 electron ở lớp vỏ ngoài ở dạng ba liên kết đơn nhưng nó cần thêm 2 electron để hoàn thành octet.
Nhưng vấn đề là chúng ta không còn bất kỳ electron hóa trị nào, do đó, trong tình huống này, chúng ta sẽ chuyển đổi một cặp nguyên tử oxy đơn lẻ thành một liên kết cộng hóa trị duy nhất.
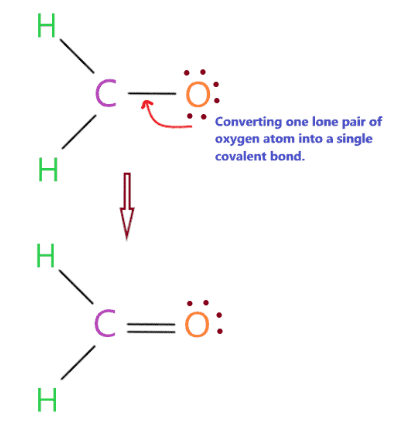
Như bạn thấy trong cấu trúc trên, chúng tôi đã chuyển đổi thành công một cặp nguyên tử oxy đơn độc thành liên kết cộng hóa trị, do đó, trung tâm carbon cũng đã hoàn thành octet của nó vì nó có 8 electron (hai liên kết đơn + một liên kết đôi) trong hóa trị của nó hoặc vỏ ngoài.
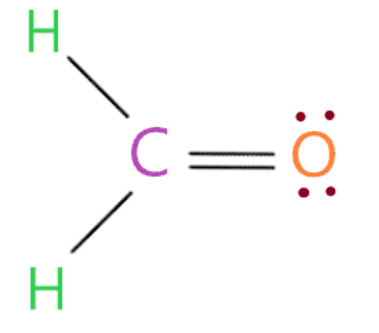
Vì vậy, bằng cách nhìn vào cấu trúc trên, chúng ta thấy nguyên tử oxy có 8 electron (6 electron được biểu thị bằng dấu chấm + 2 electron trong một liên kết đơn được kết nối với nó) trong vỏ octet của nó. Do đó, nó cũng hoàn thành octet của nó.
Trong cấu trúc trên, chúng ta đã sử dụng tổng cộng 12 electron hóa trị (ba liên kết đơn chứa 6 electron và 6 electron là dấu chấm).
Do đó, bây giờ chúng ta không còn electron hóa trị nào.
Kiểm tra tính ổn định với sự trợ giúp của khái niệm điện tích chính thức
“Điện tích hình thức trên các nguyên tử càng ít thì sự ổn định của biểu đồ lewis càng tốt.”
Để tính điện tích hình thức trên một nguyên tử. Sử dụng công thức đưa ra dưới đây

Hãy bắt đầu với nguyên tử trung tâm là cacbon trong phân tử H2CO.
Đối với nguyên tử cacbon:
⇒ Electron hóa trị của cacbon = 4
⇒ Cặp electron đơn độc trên carbon = 0
⇒ Cặp electron dùng chung xung quanh cacbon (hai liên kết đơn và một liên kết đôi) = 8
∴ (4 – 0 – 8/2) = 0 điện tích hình thức trên nguyên tử trung tâm cacbon.
Đối với nguyên tử oxi
⇒ Số electron hóa trị của oxi = 6
⇒ Cặp electron độc thân trên oxy = 4
⇒ Số cặp electron dùng chung xung quanh oxi (1 liên kết đôi) = 4
∴ (6 – 4 – 4/2) = o điện tích hình thức của nguyên tử oxi.
Đối với nguyên tử hydro
⇒ Số electron hóa trị của hiđro = 1
⇒ Cặp electron độc thân trên hydro = 0
⇒ Cặp electron dùng chung xung quanh hiđro (1 liên kết đơn) = 2
∴ (1 – 0 – 2/2) = o điện tích hình thức trên cả hai nguyên tử hydro.
Vì vậy, mỗi nguyên tử (oxy, hydro và carbon) trong cấu trúc lewis H2CO có điện tích chính thức bằng không.
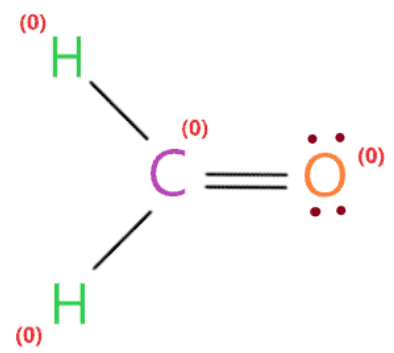
Do đó, cấu trúc lewis ở trên của H2CO là phù hợp nhất, đáng tin cậy và ổn định về bản chất vì điện tích chính thức tổng thể bằng không.
Hình học electron và phân tử của H2CO là gì?
Hình học phân tử của H2CO là phẳng lượng giác vì nguyên tử trung tâm carbon không có cặp đơn độc và được gắn vào hai nguyên tử hydro và một nguyên tử oxy với sự trợ giúp của hai liên kết đơn và một liên kết đôi. Vì vậy, có ba vùng mật độ electron xung quanh nguyên tử trung tâm carbon.
“Một vùng mật độ electron có nghĩa là nhóm các electron liên kết hoặc không liên kết có mặt xung quanh nguyên tử. Liên kết đơn, liên kết đôi hoặc thậm chí liên kết ba xung quanh nguyên tử sẽ được tính là một vùng.”
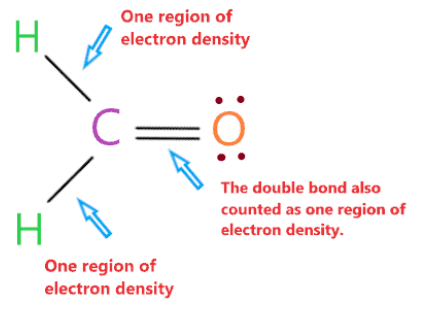
Cặp electron xung quanh nguyên tử trung tâm carbon sẽ đẩy nhau và cố gắng di chuyển ra xa nhau, chúng sẽ chiếm vị trí mà lực đẩy giữa chúng trở nên nhỏ nhất.
Theo lý thuyết VSEPR, nguyên tử trung tâm với ba vùng mật độ electron sử dụng hình học phẳng lượng giác vì lực đẩy là nhỏ nhất trong các cặp electron ở vị trí này.
Do đó, dạng hình học phân tử cuối cùng của H2CO xuất hiện dưới dạng một mặt phẳng lượng giác.
Hình dạng electron của H2CO cũng là dạng phẳng lượng giác vì không có cặp đơn độc nào có trên nguyên tử trung tâm (cacbon), do đó, chỉ cặp liên kết sẽ được tính để xác định hình dạng của H2CO.
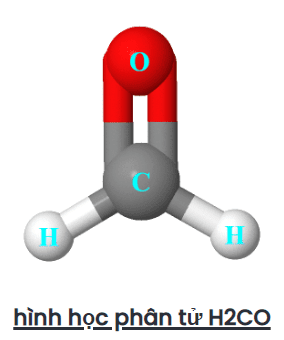
Chúng ta cũng có thể tìm thấy hình dạng electron và phân tử của H2CO bằng phương pháp AXN và biểu đồ VSEPR.
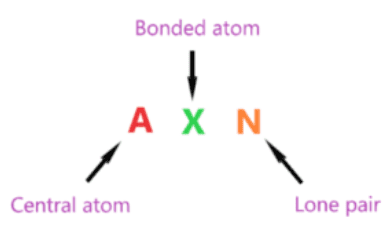
AXN là một công thức đơn giản biểu thị số lượng nguyên tử liên kết và cặp đơn độc trên nguyên tử trung tâm để dự đoán hình dạng của phân tử bằng cách sử dụng biểu đồ VSEPR.
Kí hiệu AXN của phân tử H2CO:
- A là nguyên tử trung tâm nên cacbon là nguyên tử trung tâm trong phân tử H2CO A = Cacbon
- X biểu thị các nguyên tử liên kết với nguyên tử trung tâm, carbon được liên kết với hai nguyên tử hydro và một nguyên tử oxy. Do đó, X = 3
- N đại diện cho cặp đơn độc trên nguyên tử trung tâm, theo cấu trúc lewis của H2CO, nguyên tử trung tâm carbon không có cặp đơn độc nào. Do đó, N = 0
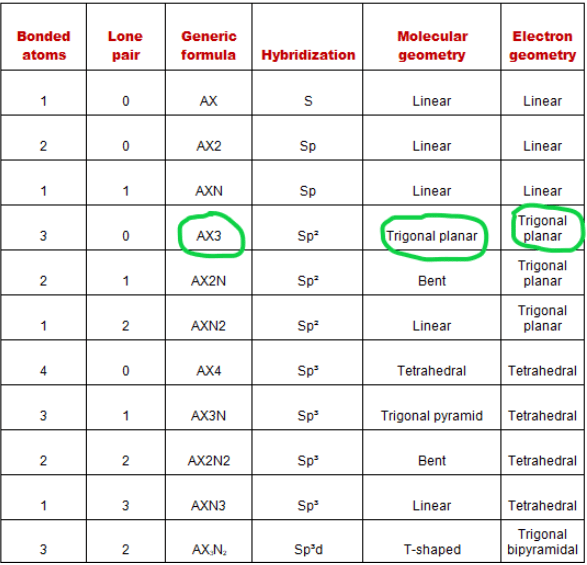
Vì vậy, công thức chung AXN cho phân tử H2CO trở thành AX 3 N 0 hoặc AX 3 .
Theo biểu đồ VSEPR, nếu một phân tử có công thức chung AX 3 thì hình học phân tử của nó sẽ là mặt phẳng lượng giác và hình học electron cũng sẽ là mặt phẳng lượng giác.
Nhìn vào biểu đồ VSEPR bên dưới
Câu hỏi thường gặp
H2CO là gì và nó có tính chất gì?
H2CO, hay formaldehyde, là một andehit, một hợp chất hữu cơ có nhóm chức -HCO-. Nó là một chất khí độc, không màu, có mùi hăng và khó chịu. Formaldehyde hòa tan trong nước và acetone, có nhiệt độ sôi -19°C và nhiệt độ nóng chảy -92°C.
Hình học phân tử của H2CO là gì?
H2CO có hình học phân tử dạng tam giác phẳng.
Làm thế nào để vẽ cấu trúc Lewis của H2CO?
Đầu tiên, đếm tổng số electron hóa trị (12). Sau đó, đặt nguyên tử carbon ở trung tâm, nối các nguyên tử hydro và oxy với carbon bằng liên kết đơn. Cuối cùng, phân bổ các electron còn lại để hoàn thành octet cho oxy (và đảm bảo hydro có 2 electron).